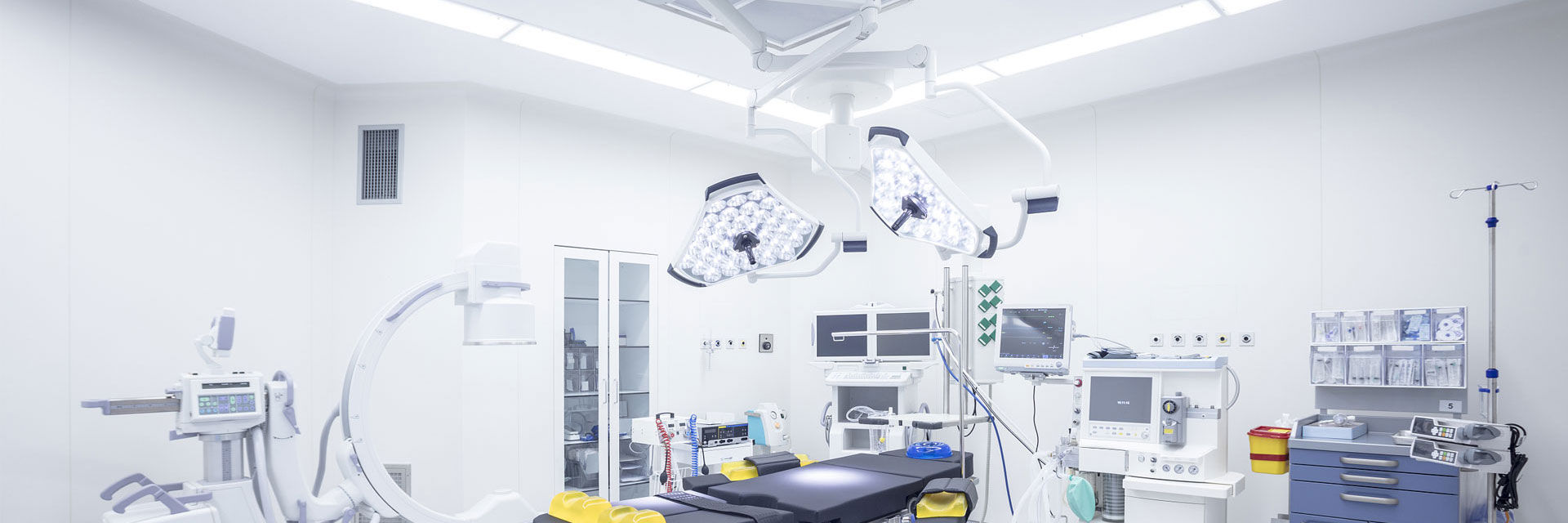
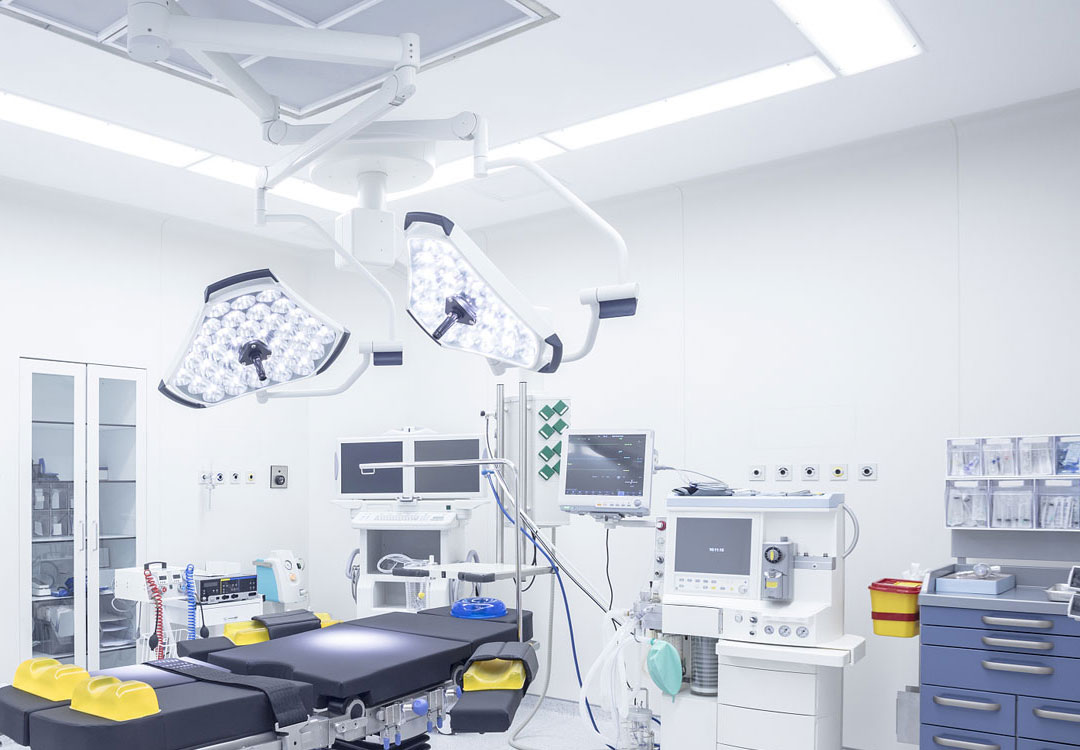
医疗器械洁净室行业痛点
医疗器械生产对洁净环境有极高要求,微小的环境问题可能直接影响患者安全
微生物污染风险
医疗器械直接接触人体,微生物污染可能导致严重感染
- 植入类器械一旦污染,可能引发深部组织感染
- 无菌器械污染将导致产品报废,造成重大经济损失
- 微生物控制不当可能影响产品生物相容性
- 洁净室微生物监测不全面,难以发现潜在污染源
交叉污染控制难题
多产品共线生产时,交叉污染风险显著增加
- 不同产品原料、辅料可能相互污染
- 清洁验证不充分,残留物难以彻底清除
- 人员流动带来外部污染物
- 设备共用增加交叉污染风险
合规性挑战
医疗器械监管要求严格,合规性验证复杂
- GMP、ISO13485等多重标准要求
- 验证文件不完整,审计时难以通过
- 环境监测数据记录不完整,追溯困难
- 变更控制管理不规范,影响系统稳定性
系统运行稳定性
洁净室系统复杂,运行稳定性直接影响产品质量
- 空调系统故障导致温湿度波动
- 高效过滤器失效影响空气洁净度
- 压差控制不稳定,增加交叉污染风险
- 设备老化导致性能下降,维护成本增加
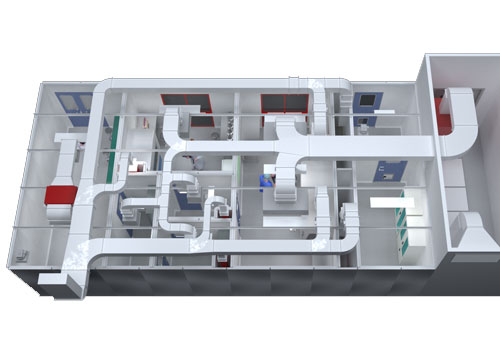
医疗器械洁净室解决方案
针对行业痛点,我们提供专业的医疗器械洁净室解决方案
植入类医疗器械
为骨科植入物、心血管支架等提供万级洁净环境
无菌医疗器械
为高要求器械等提供无菌环境
体外诊断试剂
为IVD试剂生产提供≤ISO8洁净环境
全方位无菌环境控制
针对医疗器械生产的特殊要求,提供全面的无菌环境保障方案
- A/B级洁净区设计,满足无菌医疗器械生产要求
- 高效粒子过滤系统,确保空气洁净度
- 微生物动态监测,实时掌控环境状态
- 无菌传递系统,防止交叉污染
无菌保障体系
我们建立了完整的无菌环境控制体系,从空气净化到表面消毒,从人员更衣到物料传递,确保医疗器械生产的全过程无菌保障。
GMP合规性设计
严格按照医疗器械GMP要求,设计符合认证的洁净环境
- 洁净室布局符合人流物流分离原则
- 压差梯度控制,防止交叉污染
- 环境监测系统,满足数据完整性要求
- 验证服务,支持GMP认证
合规性保障
我们的设计方案完全符合中国GMP、ISO13485等医疗器械相关标准,提供从设计、施工到验证的全流程服务,确保一次性通过认证。
专业化维护团队
拥有医疗器械行业经验的洁净室维护团队
- 医疗器械GMP认证工程师带队
- 熟悉无菌生产工艺要求
- 定期医疗器械行业专项培训
- 7×24小时应急响应能力
行业专业经验
我们的团队具有丰富的医疗器械洁净室项目经验,熟悉植入物、无菌器械等特殊产品的环境要求,能够提供专业的解决方案。
标准化验证体系
建立完整的洁净室验证体系,确保环境持续合规
- DQ/IQ/OQ/PQ验证服务
- 洁净度、风速、压差等参数验证
- 微生物监测方法验证
- 定期再验证服务
质量保证体系
我们提供完整的验证服务,包括设计确认、安装确认、运行确认和性能确认,确保洁净室从建设到运行全程符合医疗器械生产要求。
我们的优势
20余年洁净室设计建造经验,确保洁净室性能超越国际标准
服务流程

01 需求分析
02 方案设计

03 施工建设

04 系统验证

05 运维支持
获取专属解决方案
填写以下信息,我们的技术专家将在24小时内与您联系